アクチンフィラメントの構造多型と機能分化
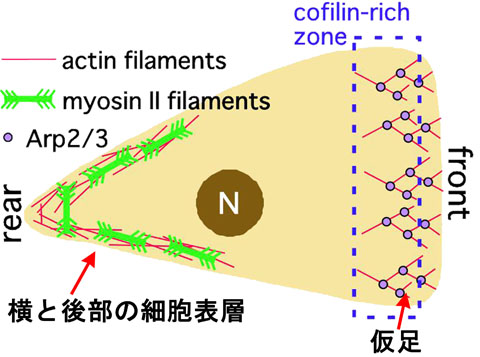
アクチンフィラメントは、真核細胞の細胞運動や細胞内物質輸送等のさまざまな現象で 非常に重要な機能を果たしています。たとえば、運動中の細胞性粘菌アメーバの前部では、 アクチンフィラメントの伸張が仮足を前方に押しだし、 後部ではミオシンIIと相互作用して後端を収縮させています(図.1)。 このように、細胞内にはアクチンフィラメントを主成分とする多様な構造が共存し、 それぞれ重要な機能を果たしています。一般にこのようなアクチンフィラメントの機能分化は、 相互作用しているタンパク質の差異に基づくと考えられています。 たとえば細胞前部のアクチンフィラメントはArp2/3依存的に重合し、 コフィリンにより脱重合します。一方後部のアクチンメッシュワークには、 ミオシンIIフィラメントやフィラミンなどが結合し、収縮性を担っています。 それでは、個々のアクチンフィラメントは、 どのようにして適切なアクチン結合タンパク質と結合するのでしょうか。 これについては、アクチンフィラメントの高次構造の差異(たとえば樹状構造とメッシュ構造)が 影響しているという可能性や、細胞局所的な生化学的シグナリング(Rhoの活性化やCaイオンの上昇など) による制御が想定されているケースもあります。 しかしそうした説明が難しいアクチン結合タンパク質も数多く、 アクチンフィラメントの機能分化メカニズムの全体像は未解明のままです。
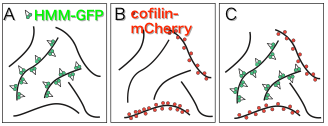
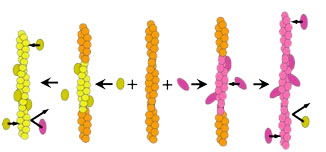
一方アクチンフィラメントの構造解析は近年大きく進歩しましたが、 アクチンフィラメントの構造には多型性があり、 単一の構造を想定すべきではないという考えが提唱されています(Galkin et al., 2010)。 これに関連してわれわれは、アクチンフィラメントと微量のHMM(ミオシンIIの可溶性断片)を ATP存在下、in vitroで混合すると、HMMがまばらに結合したフィラメントと ほとんど結合しないフィラメントが共存することを見いだしました (図2A:Tokuraku et al., 2009I)。 この現象については: ①アクチンフィラメントには協同的な構造多型があり(e.g., Egelman and Orlova, 1995)、 平衡関係にある複数の構造状態のうちいくつかがHMMと高い親和性を持っていた; ②HMMがアクチンフィラメントに結合すると、協同的な構造変化をアクチンフィラメントに引き起こす(e.g., Oosawa et al., 1972)ので、 一分子のHMMが結合すると、結合されたアクチンサブユニットから 伝播した構造変化が周囲のサブユニットのHMMに対する親和性を高め、 別のHMM分子の結合を促すことで、ドミノ倒し的にフィラメント全体が HMMに対して高親和性状態になった(図3)、 という二つの説明が可能ですが、いずれにしろ、アクチンフィラメントには HMMに対する親和性が異なる(少なくとも)二つの構造があることを示唆しています。 一方、コフィリンとアクチンフィラメントの結合も 協同的(図2B: Galkin et al., 2001)なので、 コフィリンに関しても、アクチンフィラメントにはコフィリンと親和性の高い構造と 低い構造があると考えられます。われわれは最近、HMMとコフィリン、 および過剰のアクチンフィラメントが共存すると、HMMとコフィリンは それぞれ相互排他的にアクチンフィラメントと協同的に結合することを 見出しています(貴嶋ら、2011年度生物物理学会;図2C)。 この結果は、HMMに対する親和性が高いフィラメントはコフィリンに対する親和性が低く、 逆にHMMに対する親和性が低いフィラメントはコフィリンに対する親和性が高いことを 示唆しています。以上の結果からわれわれは、 細胞内の場所によってアクチンフィラメントの構造が異なることが、コフィリン、 ミオシンIIを初めとする種々のアクチン結合タンパク質が異なった細胞内局在を 示す一因ではないかと考えるに至りました(仮説1)。
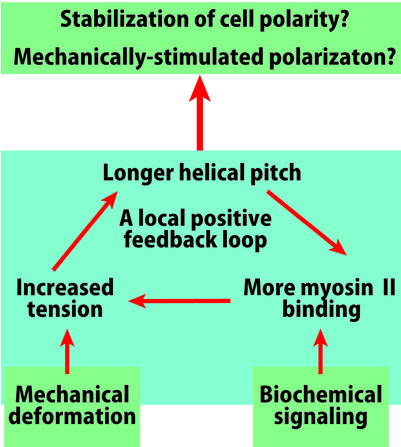
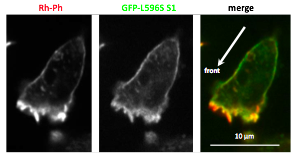
さて細胞の後部ではアクチンフィラメントとミオシンIIフィラメントの 相互作用が張力を発しますが、アクチンフィラメントを引っ張ると、 らせんピッチが伸びることが知られています (Wakabayashi et al., 1994; Matsushita et al., 2011)。 したがって細胞後部では、張力発生、ピッチの伸長、 ミオシンII結合量の増加が局所的正帰還ループを形成し、 収縮性の状態を安定化すると期待されます(図4)。 一方細胞前部では、アクチンフィラメントの重合が仮足を前に押し出すため フィラメントには圧縮力がかかります。また細胞前部に局在するコフィリンは 張力のかかっていないフィラメントと結合しやすく(Hayakawa et al., 2011)、 さらにコフィリン結合はらせんピッチを短縮する(McGough et al., 1999)ことから、 細胞前部ではらせんピッチの短縮を含む局所的正帰還ループが形成されるかもしれません。 したがって、アクチンフィラメントの構造多型を介して細胞極性が 安定化されている可能性があります(仮説2)。そもそも細胞の前後で異なる 正帰還ループができるきっかけとしては、生化学的シグナルによる制御や確率的な 揺らぎが想定されますが、力学的刺激による細胞の変形もきっかけとなり得ます (図4)。 実際、細胞の局所を外力で変形させると、その部分にミオシンIIが集積し、 後部となって細胞極性が形成されることが知られています(e.g., Verkhovsky et al., 1999)。 これらの仮説を検証するため、細胞内でアクチンフィラメントとミオシンIIモーター領域の結合を 観察したところ、予想通り張力のかかっているアクチンフィラメントは ミオシンIIモーター領域に対する親和性が強いことを見出しました (図5: Uyeda et al., 2011)。これは、上記仮説1,2を支持するものでした。しかしこの現象が、張力によるアクチンフィラメントの配向の変化等に依存したものである可能性は排除されていません。 そこでわれわれは、らせんピッチの伸長などのアクチンフィラメントの 原子構造の変化がミオシンIIモーター領域の結合を増加させることを証明するために、 in vitroでの検証の準備を進めています。 また上の説明では、ミオシンIIとコフィリンによるアクチンフィラメントの 協同的構造変化の例を出しましたが、他のアクチン結合タンパク質もアクチンフィラメントに 特徴的な構造変化を引き起こすことがわかりつつあり、それらもそれぞれに 特徴的なアクチンフィラメントの協同的構造変化を介してアクチンフィラメントの 機能分化と関係している可能性があります。 そこで、そうしたフィラメントの協同的構造多型と機能分化の関連がどの程度一般的な現象なのか、 さまざまなアクチン結合タンパク質で検証していく予定です。