細胞質分裂機構の多様性
細胞質分裂は増殖における非常に重要なステップで、核分裂後の娘核の間に 一過的に形成される収縮環がアクチン・ミオシン系のすべり運動により縮むことで 駆動されるといわれています(巾着機構)。 一方、いくつかの接着性の強い細胞種の場合、分裂直後の娘細胞は、 互いに反対方向にアメーバ運動して離れていくことが観察されています。 アメーバ運動中の細胞の後部の表層はアクチンとミオシンIIの繊維を高濃度で含み、 その収縮によって後部が引き込まれて前進運動に寄与するといわれています。 これに対してアメーバ運動中の細胞の前部では、 arp2/3依存的なアクチンの重合により仮足が前方への伸長し、 これが細胞全体の前進運動の重要な駆動力だと考えられています。 さて分裂後の娘細胞がアメーバ運動により離れていくプロセスを観察すると、 収縮環のアクトミオシンがそのままアメーバ細胞の後部の収縮性表層に なることが分かります(movie 1)。 それでは、アメーバ運動で主たる力を発生するといわれている仮足は、 分裂後の細胞ではどのような経緯で形成されるのでしょうか。 実は、分裂中の細胞の両極は、すでに活発な伸長退縮を繰り返しており(polar rufflingとよぶ)、 アメーバ運動中の前端仮足に対応する構造ができていることが分かります(Zang et al., 1997)。 では、仮足の伸長がアメーバ運動の主たる原動力であるように、 両極の伸長活性が細胞質分裂を駆動する可能性はないのでしょうか?
実はこの問題には、前段があります。 というのは、ミオシンIIのノックアウトおよびノックダウン細胞は細胞性粘菌で 初めて作製されたのですが、こうしたミオシンIIナル細胞は懸濁培養中では 細胞質分裂ができず多核化し巨大になって死ぬことから、 ミオシンIIが細胞質分裂に不可欠であると結論されたのでした(DeLozanne et al., 1986; Knecht and Loomis, 1986)。 しかしこれらの細胞も、基質上ではほとんど巨大多核化しないことは当初から 分かっており、それは、細胞周期とは無関係に巨大多核細胞の異なる部位が 反対方向にアメーバ運動することで、適当に引きちぎれて あまり多核化しないのだろうと説明されていました(traction-mediated cytofission)。 当時、私自身も何となくこの説明に納得してしまっていたのですが、 ドイツのGerischのグループでは、基質上のミオシンIIナル細胞の分裂の様子を 詳細に観察し、ほとんどの細胞は、核分裂に引きつづき赤道領域が縮んで 一見正常とほぼ同じ経緯で効率よく分裂できることを報告し、 このプロセスをattachment-assisted mitotic cleavageと名付けました(Neujahr et al., 1997)。 私自身、ミオシンIIナル細胞を日常的に使っていたので、 本来であれば自分自身でNeujahrらと同じことに気がつくべきだったのですが、 本当に思い込みとは恐ろしいものです。 さて話を元に戻しますが、ミオシンIIナル細胞は、 どのような分子機構で接着依存的に分裂するのでしょうか? ミオシンIIの収縮環活性に駆動される基質接着非依存的な分裂機構とは 物理的メカニズムの異なる新奇分裂機構があるのでしょうか、 あるいは、ミオシンII以外の分子モーターが収縮環の収縮を駆動するのでしょうか?
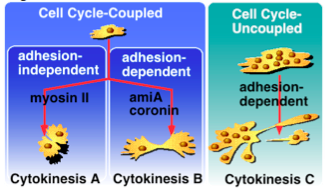
われわれはこの問題に、遺伝学的アプローチをすることにしました。 とっかかりは、当時東大須藤研の大学院生だった長崎晃(現産総研主任研究員)の変異体解析でした。 長崎らは、細胞性粘菌の走化性集合運動に欠損を持つ変異体を解析していて、 そのうちのamiAナル細胞が、細胞質分裂にも欠陥があり、特に興味深いことに、 懸濁培養よりも基質上でより強い分裂阻害が見られたのです(Nagasaki et al., 1998)。 この表現型は、懸濁培養でのみ多核化するミオシンIIナル細胞とは反対で、 もしミオシンIIナル細胞が収縮環非依存的・基質接着依存的な新奇分裂機構を持つなら、 この新奇分裂機構に関与する遺伝子の変異体に期待される表現型です。 その後の文献検索で、コロニン(アクチン結合タンパク質の一種)の ノックアウト細胞も同様に、基質上でより強い細胞質分裂能欠損を示すことが判明し、 われわれは、これらを組み合わせた遺伝学的な解析を行うことにしました。 その結果、amiAナル・ミオシンIIナルおよびコロニンナル・ミオシンIIナルの 二重変異株は、懸濁培養でも基質上でも非常に強い細胞質分裂阻害を示したのに対して、 amiAナル・コロニンナルの二重変異株は、amiAナルやコロニンナルと同程度の 弱い基質上での分裂阻害を示すことが明らかになりました。 この結果から、細胞質分裂には、ミオシンIIに依存した機構(cytokinesis A)と amiAとコロニンの両方に依存した機構(cytokinesis B)の明確に異なる二つの 機構があって、懸濁培養での分裂には前者が必須であり、 一方、基質上の分裂では、前者と後者がともに機能重複していることが明らかになりました (図1: Nagasaki and Uyeda, 2002)。
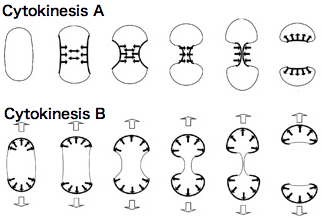
さらに、両プロセスの詳細な形態観察や、細胞が基質に及ぼす力の 直接測定(Uchida and Yumura, unpublished)、cytokinesis Aは収縮環の収縮により 駆動されるのに対して、cytokinesis Bは両極の伸長運動により駆動されることが 確立されました(図2)。 これは、アメーバ運動における細胞後部と前部の運動性と対応しています。
以上は変異体解析が容易な細胞性粘菌を用いて得られた結果ですが、 それでは高等動物の細胞の場合はどうでしょうか。 ウニや線虫の卵のように基質に接着していない細胞の分裂には、 cytokinesis A(収縮環の活性)が不可欠であることが分かっていますが、 これは、懸濁培養の粘菌細胞の分裂がcytokinesis Aに 依存することと対応すると考えられます。 これに対して、基質に接着しアメーバ運動をする細胞の場合については、 ミオシンの活性を阻害すると分裂速度が遅くなったり分裂失敗の頻度が 増えるという報告はたくさんありましたが、cytokinesis Aが不可欠かどうかに ついて明確な結論は得られていませんでした。 これは、たとえばヒトのゲノムには非筋細胞型のミオシンII重鎖遺伝子が 3つもあり、遺伝子ノックアウトは言うに及ばず、 siRNAを用いた遺伝子ノックダウンも困難で、ミオシンII遺伝子ノックダウンにより 部分的な分裂阻害が観察されても、それは遺伝子ノックダウンが不完全であったためか、 ミオシンIIなしでもある程度分裂が進行するのかの見極めをつけられなかったという事情があります。 しかしこうした技術的困難は、ミオシンIIに対する特異的阻害剤blebbistatinの 開発である程度解決されました。 そして、高等動物細胞のモデルとしてよく取り上げられるHeLa細胞に blebbistatinを投与したところ、細胞質分裂がほぼ完全に阻害され、 高等動物細胞の分裂もミオシンIIに依存する(つまり cytokinesis A機構が主である)、 と結論されました(Straight et al., 2003)。 しかしHeLa細胞はがん細胞で基質との接着が弱く、分裂時には基質から完全に脱離しますので、 動物細胞の典型例とは言い難いところがあります。 そこでわれわれは、normal rat kidney (NRK)細胞をフィブロネクチンを 塗布した基質上で培養したところ、blebbistatin存在下でも効率よく分裂できることを 発見しました。このときの形態変化は、ミオシンIIナルの細胞性粘菌の分裂と よく似ており、両極の前進運動が原動力であると示唆されました(Kanada et al., 2005)。 つまり、cytokinesis B機構は、細胞性粘菌からほ乳類細胞まで 広く保存されていることになります。なお進化的には、ミオシンアクチン系の 力発生機構(cytokinesis Aを駆動)はアクチンフィラメントの重合に基づく 運動機構(cytokinesis Bを駆動)より新しいと考えられており(Mitchison, 1995)、 cytokinesis BはAより原始的で基盤的な分裂機構だろうと推測しています。
さて高等動物の体細胞も、生理的条件(ECMを介して基質に接着している)では cytokinesis Bを行いうることがはっきりしましたが、 この能力が個体内でどのような機能を果たしているのかは明らかではありません。 ショウジョウバエの非筋ミオシンIIのノックアウトは致死ですが、 変異体の胚は細胞質分裂欠損ではなく形態形成異常により発生が停止する(Young et al., 1993)ので、 cytokinesis Bだけでもある程度正常に分裂できるのかもしれません。 同様な解釈が可能な結果はマウスでも得られています(Takeda et al., 2003)が、 マウスには非筋ミオシンII重鎖遺伝子が三つもあり、 解釈がより難しくなっています。さらに高等動物細胞の場合は細胞極性の 維持形成などにもミオシンIIが寄与することが分かっており、 ミオシンIIを持たない変異細胞が個体内で増殖できるかどうかを基準に個体内の 細胞質分裂にミオシンIIが必要を判断することもできないので、 今後、適切な実験系の確立が待たれています。一方、HeLa細胞の分裂は cytokinesis A依存的であり、多くのがん細胞においてHeLaと同様に 基質接着性が弱まっていることから、もし体内の正常細胞がcytokinesis Bで 分裂できるなら、cytokinesis A経路はガンに対する創薬ターゲットになり得るかもしれません
以上、cytokinesis AとBのお話をしましたが、このほかに細胞性粘菌には、 ミオシンIIナル細胞が構築されたときに最初に観察された traction-mediated cytofissionもあります。 これは、基質接着とアメーバ運動に依存するという点でcytokinesis Bと似ていますが、 細胞周期とは無関係に適当にちぎれる様式の分裂であり、 両者は明確に区別するべきものと思われます。 そこでわれわれは、 traction-mediated cytofissionをcytokinesis Cと名付けました。 では、cytokinesis A, B, Cで細胞性粘菌の分裂様式はすべてでしょうか。
Entamoeba invadensという原生動物アメーバがあり、 イスラエルのBiron(2001)らは、これらのアメーバは赤道を能動的に 収縮させることができるけれども自分自身の力で最後の切断をすることができず、 代わりに走化性誘引物質を分泌し、周囲の細胞を引き寄せてちぎってもらうという 驚くべき発見を報告しました。 彼らはこの分裂を助産婦(midwife)メカニズムとよんでいます。 一方われわれは、分裂中の細胞性粘菌の顕微鏡ムービーを撮影していると、 しばしば周囲の細胞が分裂細胞にまとわりついてきて、分裂のムービーとしては 絵にならないことになってしまうことが多く、困っていました。 しかしこのBironらのmidwifeの論文に接し、粘菌にも同じ助産婦現象がある!と 気がつきました。その後実際に、走化性運動の変異体を用いて、 粘菌においても走化性運動に基づく助産婦現象があることを証明しました (Nagasaki and Uyeda, 2008)。 この助産婦現象は、赤道が収縮するメカニズムではなく、 縮んだ赤道領域を最後に切断する(abscissionとよばれる)ためのメカニズムですので、 cytokinesis A, B, Cと同列に論ずることはやや不適切かもしれませんが、 われわれはこれをcytokinesis Dとよび、細胞性粘菌における4番目の分裂機構としました。 Cytokinesis Dがどの程度一般的な現象なのかはまだよく分かっていませんが、 Entamoebaと細胞性粘菌は系統的に離れているので、 単一の系統群でのみ進化したものではないと考えています。
一般に動物細胞の細胞質分裂といえば巾着機構(cytokinesis A) しか想定しない人が大半で、教科書もそうなっていますが、 話はそんなに単純ではないことを再度強調したいと思います (Uyeda and Nagasaki, 2004; Uyeda et al., 2004)。 植物や菌類はまた異なるメカニズムで分裂し、 真核細胞の分裂の多様性はまだまだ広がっていく様な印象がありますが、 逆に、植物細胞の分裂と、動物細胞のabscissionの間に類似性が指摘されており、 いずれ、もう少し共通的なメカニズムが考えられるようになるのではないかと 期待しています。