ナノアクチュエータとしての分子モーター
タンパク質分子モーターは、細胞全体の運動を駆動するだけではなく、 細胞内の物質輸送にも中心的な役割を果たしています。 たとえば神経軸索の中では微小管が方向性をそろえて並んでおり、 その上をキネシン分子モーターが神経伝達物質の詰まった膜胞を輸送しています。 こうししたタンパク質分子モーターは、個々の分子がモーターなので大変小さい 反面、タンパク質の一般的性質としてかなり大きな構造を自己組織化的に 組み上げるポテンシャルをもつなど、人工モーターにはない様々な特徴をもっています。 そこでこれらをナノアクチュエータとして利用しようという応用研究が世界中で模索されていました。
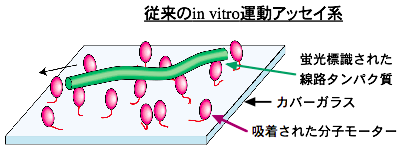
従来タンパク質分子モーターを生体外に取り出して運動させるときは、 タンパク質分子モーター(例えばキネシン)をガラス面に吸着させ、 蛍光標識した線路タンパク質(キネシンに対しては微小管)が その上を運動するという、生体内とはジオメトリーを逆転させた系が 主に用いられてきました(図1, movie 1)。 こうしたシステムが1980年代に開発され、精製したタンパク質分子モーターの 運動活性をin vitroで定量的に評価できるようになったのですが、 微小管はガラス面上をランダムな方向に運動するので、 外部に対して有用な仕事をさせることはできないため、 実用を目指した応用研究には限界がありました。
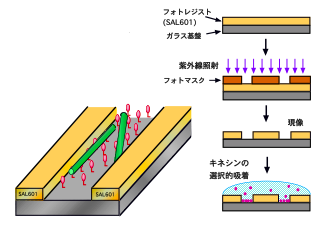
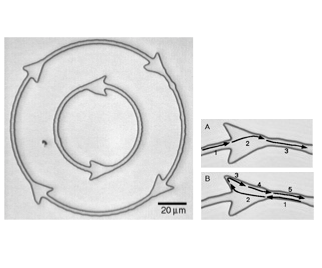
そこでわれわれは、図2に示すようなトラックを ガラス面上にリソグラフィーで作製し、その底面だけにキネシンを 結合させたところ、微小管の運動を一次元に制限することに成功しました。 さらに矢じり状のパターンを付加することで、ほとんどすべての微小管を 一方向に運動させることができるようになりました(図3, movie 2: Hiratsuka et al., 2001)。 この成果がブレークスルーとなり、微小管に運びたい荷物を結合させる技術、 光などの外部刺激で運動活性をスイッチする技術、あるいは電場により 分かれ道で進行方向を制御する技術、微小管を濃縮するパターンの開発などが進み、 タンパク質分子モーターによる微小輸送系をµTASなどの人工的環境で実用化が 近づきつつあります。
しかし、上記のような応用例では、自己組織化能にもとづいて有用な高次構造を 自発的に形成するというタンパク質の特徴は生かされていないため、 タンパク質ナノアクチュエータとしての利点がフルに生かされているとは 言い難い面があります。生体分子の自己組織化能を活用した高次構造形成という 研究は、設計の容易なDNAで大きく進展していますが、 タンパク質の自己組織化能の人工的なデザインは研究が遅れています。 そこでわれわれは、精製したタンパク質分子モーターを 自己組織化していくのではなく、タンパク質分子モーターを含む運動性の生体構造を、 自己組織化による組み立て済みの運動素子として人工的環境で利用しようという、 より生物学的なアプローチも検討しました。
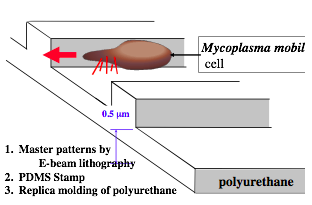
具体的には、基板上を高速(3 µm/s)で直進運動するという、 とてもユニークな特徴をもつ滑走細菌Mycoplama mobileの活用です (movie 3)。われわれはまず、Mycoplamaもリソグラフィーに より形成された壁に沿って動くことを見いだし、この性質を利用して 一方向性運動させることができるようになりました (図4: Hiratsuka et al., 2005)。
この系の応用として、人工的な微小ローターを回転運動させることにも 成功しました(図5, movie 4: Hiratsuka et al., 2006)。 これは、微生物によって駆動される初めてのモーターです。
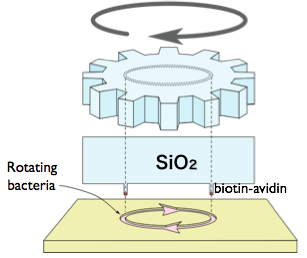
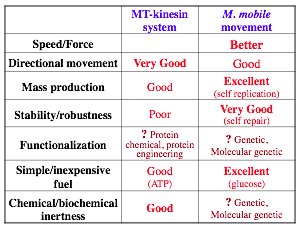
精製した微小管とキネシンを使う系では、精製の手間がかかるうえ、 蛋白質の変性にともなって不可逆的に運動性が失われるなどの問題がありますが、 Mycoplamaには自己複製・自己修復能があり、そうした問題は少ないはずです。 いまでこそわれわれは完全合成した乗り物(自動車)を使いこなしていますが、 その前は牛馬に頼っていた時代が長かったことを思うと、ナノバイオの分野でも、 当分はミクロの牛馬が活躍することになるのかもしれません。
なおこの一連の研究は、北陸先端大学の平塚祐一研究室で引き継がれています (平塚研究室HP)。