変異アクチンを用いたアクチンの機能解析
アクチン分子が構造変化を起こすことはよく知られています。 G-アクチンとフィラメント中のアクチンの構造が違うことは明らかですし、 フィラメント中のアクチンも、ADP結合型とATPやADP+Pi結合型では 構造が異なることもよく知られています。しかしこうした構造多型は、 重合の調節という観点から議論されることが多かったように思われます。 これに対して近年、アクチンフィラメント単体やフィラメントと アクチン結合タンパク質の複合体の電子顕微鏡による解析が進み、 フィラメント単体でも協同的な構造多型 (ここで「協同的」とは、フィラメント中のサブユニットには いくつかの異なる構造があるが、同一フィラメント内の連続した サブユニットは同じ構造をとりやすいという意味)が見られること(Galkin et al., 2010)*、 および種々のアクチン結合タンパク質の結合は、それぞれ特徴的な構造変化を フィラメントに引き起こすこと(e.g., McGough et al., 1997)などが分かってきました。 また、引っ張られることでらせんピッチが伸びるような構造変化が 起きることもわかっています(Wakabayashi et al., 1994; Matsushita et al., 2011)。
それでは、こうしたアクチンフィラメントの構造多型には どのような意義があるのでしょうか。 まず第一の仮説として考えられるのは、 「アクチンフィラメントの構造多型と機能分化」 のページで説明したような、フィラメントの機能分化との関連です。 一方、骨格筋HMMがアクチンフィラメントに協同的な構造変化を引き起こすことが Oosawaらの先駆的研究 (Oosawa et al., 1972) などで示されていますし、 最近では、一分子FRET実験によりミオシンと相互作用するアクチンは 構造が変化していることが示されています(Kozuka et al., 2006)。 一方、グルタルアルデヒドで分子内架橋処理をしたアクチンフィラメントは、 ミオシンIIと結合できるにも拘わらず運動活性がなくなる (Prochniewicz and Yanagida, 1990)ことなどから、 ミオシンとの運動にアクチンサブユニットの構造変化が必要だと示唆されています。 ただしその場合であっても、ミオシンと相互作用できるように アクチンフィラメントが機能分化する必要があるのか、 あるいは、ミオシンがATP分解サイクルを回るのに共役して アクチンサブユニットも構造変化サイクルを回る必要があるのかは明らかではありません。 前者であれば、第一の仮説の中に含まれる具体的なケースということになりますが、 後者であれば、アクチンの構造変化がミオシンによる力発生に密接に 関連することになりますので、これを第二の仮説とすることにします。 第二の仮説のバリエーションとして、Suzukiら (2004) は、 アクチンフィラメントまわりのhyper mobile waterの量が増減し、 これがミオシンによる力発生に重要な役割を果たしていると提唱しています 。
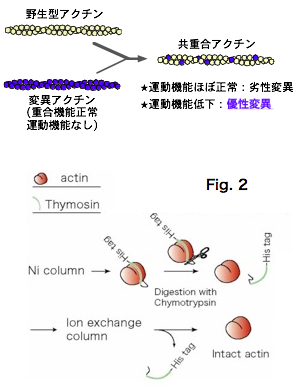
このように、アクチンフィラメントの協同的構造変化は事実だとしても、 その機能についてはまだ仮説を議論している段階にあります。 そこでわれわれは、この問題に変異アクチンを使ってアプローチしていきたいと考えました。 さて第一の仮説でも第二の仮説でも、もし協同的構造変化が機能的に重要であるなら、 構造変化が長さ方向に伝播するのを阻害する様な変異アクチンがフィラメントに 取り込まれてしまうと、そのフィラメントは機能不全を起こすと期待されます (図1)。 したがって、数ある変異アクチンの中から、優性変異を選んで解析すれば、 フィラメントの協同的構造変化の機能に関する知見が得られるのではないかと期待されます。
しかし優性変異アクチンの解析には二つの困難がありました。 というのは、組換えアクチンは真核細胞で発現する必要があるのですが、 優性変異アクチンは発現ホストのアクチンと共重合し、 ホストに害を与えるおそれがあるのです。また、ホストの内在性アクチンと 分離するためには精製用のタグを融合することが必要になりますが、 HisタグやFLAGタグはアクチンを凝集させてしまうことも知られていました。 そこでわれわれはまず、発現したい組換えアクチンと、 アクチンの重合を阻害するチモシンを融合し、さらにチモシンにHisタグをつけ、 アクチン-チモシン-His融合タンパク質を精製後に、 安価なキモトリプシンでアクチンとチモシン-Hisの間を切断し、 両者をイオン交換クロマトグラフィーで分離することで、 効率的に優性阻害型の変異アクチンを単離精製できるようになりました (Noguchi et al., 2007)。
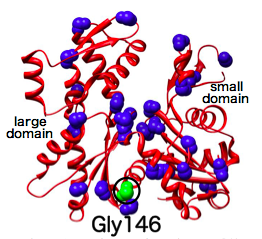
われわれはこの系を使い、ショウジョウバエの飛翔筋の遺伝学的実験系から 同定されていた優性阻害型の変異アクチンの生化学的解析を行ったところ、 いろいろ興味深い結果は得られましたが、残念ながら、フィラメントの協同的構造変化に 関する有益な知見を得ることはできませんでした (Noguchi et al., 2009)。 そこでわれわれは、酵母の増殖能を優性に阻害する変異アクチンのスクリーニングを 行うことにしました。ここでわれわれは、タンパク質の大規模な構造変化には グリシン残基が重要な働きをすることが多いという経験則に着目し、 グリシン残基を個別にあるいは適宜クラスター化してバリンに置換するという 「グリシンスキャニング」法を考案し、酵母アクチンがもつ30個のグリシンに 適用しました(ちなみにアクチンは非常に保守的なタンパク質で、 これらのグリシンは既知のアクチン配列で全て完全に保存されています)。 その結果、6個の優性変異を同定することができました (Noguchi et al., 2010)が、 そのうちG146V変異はアクチンの二つのドメインの間の蝶番と思われる部位に位置し、 ドメイン間の構造変化に影響を及ぼすと推測されたので、 この変異アクチンに着目した詳細な研究を進めています。
その結果、G146Vアクチンフィラメントは、細胞内の主要な アクチン脱重合因子であるコフィリンと結合できないことが分かりました。 さらに興味深いことに、G146Vアクチンと野生型アクチンを1:10の割合で 共重合させたフィラメントも、ほとんどコフィリンを結合できませんでした。 この結果は、G146Vアクチン変異アクチンが、近傍の正常アクチンサブユニット 10個の構造に影響を与え、コフィリンと結合できなくしてしまったこと (朱に交われば赤くなる)を示唆し、アクチンフィラメントにおける強力な 協同的構造変化の一端を示しています。
G146Vアクチンフィラメントはまた、ミオシンIIを運動させる 活性(速度、力ともに)が1/4程度に低下していました。 ただし大変不思議なことに、ミオシンVの運動性はまったく阻害しませんでした。 生化学的解析などの結果、ミオシンIIの運動阻害は、G146V変異の結果、 モータードメインとのいわゆる強い結合が阻害されたためであることが 分かっていますが、いくつかの状況証拠から、 単純にミオシン結合サイトが物理的に破壊されたためではなく、 ミオシンが強く結合するために必要なアクチン側の構造変化が 阻害されたためであると考えています (Noguchi et al., 2012)。 この点をさらに確認するため、アクチンの一分子FRETアッセイを行い、 ミオシンII結合によるアクチンの構造変化を野生型とG146Vとで比較したところ、 両者に顕著な違いが見出されています(野口ら、2011年生物物理学会)。 この研究は、都城高専に移った野口太郎研究室と共同で進めています (野口研究室HP)。
それではなぜG146Vアクチンは酵母の増殖を優性に阻害するのでしょうか。 一つの答としては、G146Vアクチンは野生型と共重合しても、 「朱に交われば赤くなる」式にフィラメント全体の構造を特定のものに 固定してしまうためだろうと考えられます(こうした共重合フィラメントの構造が、 野生型アクチンフィラメントが取りえる複数の構造のうちの一つと同じなのか、 あるいは自然状態では存在しないものなのかは不明ですが、 われわれは前者を期待しています)。ではさらに突き詰めて、 そうした異常な構造のフィラメントがなぜ増殖を阻害するのかですが、 コフィリンが増殖に必須であることから、コフィリンとの相互作用が 強く阻害されるためだろうとわれわれは考えています。
これと関連して、われわれは最近、D11QやK336Iといった優性阻害型のアクチンも、 野生型クチンと共重合してコフィリンとの相互作用を阻害することを見出しています (Umeki, Nakajima et al., 論文投稿中、Umeki and Uyeda, unpublished)。 ヒトのαアクチンにおけるD11NやK336I変異は先天的なミオパチーを 引き起こすことが分かっており、優性に病気を引き起こすアクチン変異のうち、 かなりのものは、野生型との共重合フィラメントがコフィリンと正常に 相互作用できなくなることが病因なのではないかと推測しています。